Phương pháp giải những dạng bài tập chương Đại cưng cửng về hóa học hữu cơ
Với phương thức giải những dạng bài tập chương Đại cương về chất hóa học hữu cơ Hoá học lớp 11 tổng hợp các dạng bài bác tập, bài bác tập trắc nghiệm gồm lời giải cụ thể với đầy đủ cách thức giải, lấy ví dụ như minh họa để giúp đỡ học sinh ôn tập, biết phương pháp làm dạng bài xích tập chương Đại cương về hóa học hữu cơ từ đó đạt điểm cao trong bài xích thi môn Hoá học lớp 11.
Bạn đang xem: Các dạng bài tập hóa hữu cơ 11

Bài tập kim chỉ nan về hợp hóa học hữu cơ
Bài 1: phản bội ứng hóa học của những hợp hóa học hữu cơ có đặc điểm là:
A. Thường xẩy ra rất nhanh và đến một sản phẩm duy nhất.
B. Thường xẩy ra chậm, không trả toàn, không áp theo một hướng nhất định.
C. Thường xảy ra rất nhanh, không trả toàn, không áp theo một hướng duy nhất định.
D. Thường xẩy ra rất chậm, nhưng hoàn toàn, không theo một phía xác định.
Lời giải:
Đáp án: B
Bài 2: phát biểu nào sau đây không đúng?
A. trong phân tử hợp hóa học hữu cơ, cacbon tất cả hóa trị 4 hoặc 2.
B. Việc biến hóa thức tự các liên kết của nguyên tử trong phân tử hữu cơ đã làm biến đổi cấu sinh sản hóa học tạo thành chất mới.
C. Để xác định sự xuất hiện của nhân tố halogen vào hợp chất hữu cơ, fan ta đốt cháy hợp chất hữu cơ và cho qua hỗn hợp Ag
NO3
D. chẳng thể định lượng trực tiếp nhân tố oxi vào phân tử hợp hóa học hữu cơ.
Lời giải:
Đáp án: A
Bài 3: chất nào sau đây thuộc nhiều loại chất hữu cơ ?
A. Al2C4 B. CH4 C. teo D. Na2CO3.
Lời giải:
Đáp án: B
Bài 4: liên kết hóa học trong phân tử hóa học hữu cơ chủ yếu là links
A. cộng hóa trị B. Ion C. kim loại D. Hiđro.
Lời giải:
Đáp án: A
Bài 5: chất nào sau đây trong phân tử có link đôi ?
A. C2H4 B. C2H2 C. C3H8 D. C2H5OH.
Lời giải:
Đáp án: A
Bài 6: Thành phần những nguyên tố vào hợp chất hữu cơ
A. tốt nhất thiết phải gồm cacbon, thường có H, hay gặp mặt O, N sau đó đến halogen, S, P,...
B. Gồm tất cả C, H và các nguyên tố khác.
C. bao gồm tất cả các nguyên tố trong bảng tuần hoàn.
D. thông thường sẽ có C, H hay gặp gỡ O, N, tiếp đến đến halogen, S, P,...
Lời giải:
Đáp án: A
Bài 7: Cho một trong những phát biểu về điểm sáng chung của những phân tử hợp hóa học hữu cơ
1. Nguyên tố nguyên tố chủ yếu là C với H.
2. Rất có thể chứa nguyên tố khác như Cl, N, P, O.
3. Links hóa học đa số là liên kết cộng hóa trị.
4. Link hóa học chủ yếu là liên kết ion.
5. Dễ cất cánh hơi, nặng nề cháy.
6. Bội phản ứng hóa học xẩy ra nhanh.
7. Bội phản ứng xảy ra theo không ít hướng
Các câu đúng là
A. 1, 2, 5, 6. B. 1, 2, 3, 5. C. 1, 2, 3, 7. D. 1, 2, 4, 6.
Lời giải:
Đáp án: C
Bài 8: kết cấu hóa học là
A. con số liên kết giữa những nguyên tử trong phân tử.
B. con số các nguyên tử vào phân tử.
C. thiết bị tự links giữa các nguyên tử trong phân tử.
D. thực chất liên kết giữa các nguyên tử vào phân tử.
Lời giải:
Đáp án: C
Bài 9: Công thức đơn giản và dễ dàng nhất của hợp chất hữu cơ là
A. Công thức biểu hiện số nguyên tử của mỗi nguyên tố trong phân tử.
B. Công thức biểu hiện tỉ lệ tối giản về số nguyên tử của những nguyên tố vào phân tử.
C. Công thức biểu thị tỉ lệ về hóa trị của từng nguyên tố trong phân tử.
D. Công thức biểu hiện tỉ lệ về trọng lượng nguyên tố có trong phân tử.
Lời giải:
Đáp án: B
Bài 10: Nung một hợp chất hữu cơ X cùng với lượng dư hóa học oxi hóa Cu
O fan ta thấy bay ra khí CO2, khá H2O với khí N2. Lựa chọn kết luận đúng chuẩn nhất vào các kết luận sau :
A. X chắc chắn chứa C, H, N và có thể có hoặc không có oxi.
B. X là hợp chất của 3 yếu tố C, H, N.
C. hóa học X chắc chắn rằng có cất C, H, hoàn toàn có thể có N.
D. X là hợp hóa học của 4 thành phần C, H, N, O.
Lời giải:
Đáp án: A
Bài 11: mục tiêu phân tích định đặc điểm hữu cơ là
A. tan trong nước, không tan trong dung môi hữu cơ.
B. ánh nắng mặt trời nóng chảy, nhiệt độ sôi cao.
C. xác định phân tử khối của chất hữu cơ.
D. xác minh các nhân tố trong phân tử chất hữu cơ.
Lời giải:
Đáp án: D
Bài 12: mục tiêu của phân tích định lượng hóa học hữu cơ.
A. xác định nhiệt độ sôi của chất hữu cơ.
B. khẳng định phần trăm cân nặng các thành phần trong phân tử hóa học hữu cơ.
C. Xác định cấu tạo của chất hữu cơ.
D. khẳng định các yếu tắc trong phân tử chất hữu cơ.
Lời giải:
Đáp án: B
Bài 13: hóa học nào sau đây có phân tử có links ba ?
A. C2H4 B. C2H2 C. CH4 D. CH3OH.
Lời giải:
Đáp án: B
Bài 14: hóa học nào sau đây là hiđrocacbon ?
A. CH2O B. C2H5Br C. C6H6 D. CH3COOH.
Lời giải:
Đáp án: A
Bài 15: chất nào sau đó là dẫn xuất của hiđrocacbon ?
A. CH4 B. C2H6 C. C6H6 D. C3H6Br.
Lời giải:
Đáp án: D
Dạng bài tập hotline tên hợp chất hữu cơ
A. Phương pháp giải và Ví dụ minh họa
Bước 1: chọn mạch cacbon chính. Đó là mạch cacbon nhiều năm nhất hoặc ít cacbon nhưng đựng nối đôi, nối ba, nhóm thế, nhóm chức, …
Bước 2: Đánh số thứ tự những nguyên tử cacbon vào mạch chính xuất phát từ phía gần team chức, nối đôi, nối ba, nhóm thế, mạch nhánh.
Quy tắc đánh số, theo vật dụng tự sau:
+) nhóm chức → nối đôi → nối cha → mạch nhánh
+) Đối cùng với hợp hóa học tạp chức thì ưu tiên lần lượt:
Axit → andehit → rượu
Bước 3: xác định nhóm ráng và địa điểm của bọn chúng trên mạch cacbon chính.
Bước 4: hotline tên
+) Trước tiên call tên các nhóm cố kỉnh và địa chỉ của bọn chúng trên mạch cacbon chính, sau cuối gọi tên hợp chất ứng cùng với mạch cacbon chính.
Chú ý: Mạch cacbon yêu cầu liên tục, không tồn tại nguyên tố không giống chen vào giữa, ví dụ: CH3-CH2-O-CH(CH3)2 tất cả 2 mạch cacbon, hầu như là mạch thẳng.
+) Nếu có không ít nhóm nuốm giống nhau thì gộp bọn chúng lại với thêm từ bỏ đi (2), tri (3), tetra (4), penta (5), …
+) Theo qui ước: con số chỉ vị trí nhóm vắt đặt trước tên thường gọi của nó, số lượng chỉ vị trí nối đôi, nối ba, team chức (ở mạch cacbon chính) đặt ở phía sau.
Ví dụ minh họa
Bài 1:
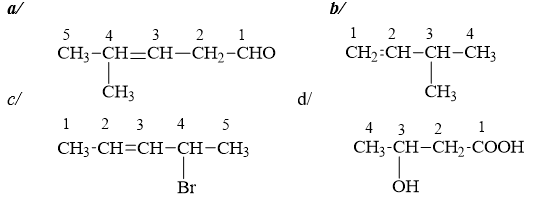
Hướng dẫn:
a/ 4- metylpen -3-en-1-al
b/ 3-metylbut-1-en
c/ 4-brompen-2-en
d/ 3–hidroxylbutanoic
Bài 2:
a/ CHCl2 - CHCl2.
b/ Cl – CH2 – CH – CH – CH3
CH3 CH3
c/ CH3 - CH2-Br
d/ CH3 CH2-O-CH2CH3
Hướng dẫn:
a/ 1, 1, 2, 2 – tetracloetan
b/ 1 - clo , 2 , 3 – đimetylbutan
c/ etyl bromua
d/ đietyl ete
Khi biết tên gọi viết công thức cấu tạo
Căn cứ vào đuôi của tên thường gọi để xác minh chất ứng với mạch cacbon chủ yếu ( hiểu ngược).
Bài 3:
a/ 1, 1, 2, 2-tetracloetan:
b/ 1- clo – 2, 3- đimetylbutan:
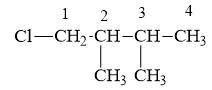
c/ 4-clo- 2, 4- đimetylpent-2-en:
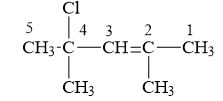
d/ Isopropylxiclohexan:
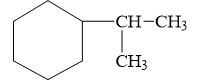
e/ 4-metylpent-2-in
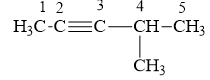
B. Bài bác tập trắc nghiệm
Bài 1: chất X gồm công thức CH3 – CH(CH3) – CH = CH2. Tên thay thế sửa chữa của X là
A. 2-metylbut-3-en B. 3-metylbut-1-in.
C. 3-metylbut-1-en D. 2-metylbut-3-in
Lời giải:
Đáp án: C
Bài 2: Hợp hóa học CH3CH(OH)CH2CH2CH3 có tên gọi là
A. but- 2-ol B. pent- 2-ol
C. isopentan D. pent- 4-ol
Lời giải:
Đáp án: B
Bài 3: Hợp chất (CH3)2CHCH2C(CH3)3 có tên gọi là
A. 2,2,4-trimetylpentan B. 2,2,4,4-tetrametytan
C. 2,4,4-trimetyltan D. 2,4,4,4-tetrametylbutan
Lời giải:
Đáp án: A
Bài 4: 2-metylbutan là tên thường gọi của hợp chất nào sau đây:
A. (CH3)2CHCH2CH3 B. (CH3)2CHCH3
C. CH3CHCH2CH2CH3 D. CH3-C(CH3)2-CH3
Lời giải:
Đáp án: A
Bài 5: CTCT sau có tên gọi là :
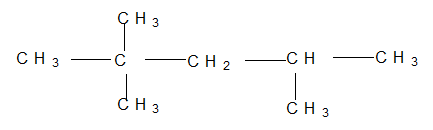
A. 2,2,4-trimetyl pentan. B. 2,4-trimetyl petan.
C. 2,4,4-trimetyl pentan. D. 2-đimetyl-4-metyl
Lời giải:
Đáp án: A
Bài 6: tên gọi của CH2=C(CH2)CH2-CH3
A. 2-metylbut-1-en B. 2-metylbut-2-en
C. 2-metylbut-1-en D. 2-metylbut-2-en
Lời giải:
Đáp án: A
Bài 7: tên gọi 3,3-đimetylbut-1-en là của hợp chất nào:
A. CH2=CH-CH(CH3)-CH3
B. CH2=CH-C(CH3)2-CH3
C. CH2=C(CH3)-CH(CH3)-CH3
D. CH2=CH2-C(CH3)2-CH3
Lời giải:
Đáp án: B
Bài 8: tên gọi của CH3 – C ≡ C - CH2 - CH3 là
A. 2- metyl- but- 2in B. Pent-3-in
C. But-2-in D. Pent-2-in
Lời giải:
Đáp án: D
Cách viết đồng phân của hợp chất hữu cơ
A. Phương pháp giải & Ví dụ minh họa
- xác định độ bất bão hòa của phân tử hợp chất hữu cơ qua công thức:
Xét CTPT của hợp hóa học hữu cơ có dạng: Cx
Hy
Oz
Nt
Clu
Độ bất bão hòa:
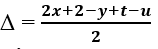
Biết Δ = số π + số vòng từ bỏ đó xác minh được dạng công thức của vừa lòng chất.
Ví dụ minh họa
Bài 1: Hợp hóa học X gồm CTPT C4H8. Xác minh các đông phân cấu trúc của X
Hướng dẫn:
Ta có: Δ = (2.4+2-8)/2= 1 &r
Arr; có 1 lk π hoặc 1 vòng &r
Arr; bao gồm 2 dạng mạch cacbon:
- Mạch hở có 1 liên kết đôi trong phân tử
+ Mạch chính 4C: C-C-C-C viết được 2 TH đồng phân địa chỉ nối đôi:
CH2 = CH-CH2 –CH3 và CH3 - CH=CH –CH3
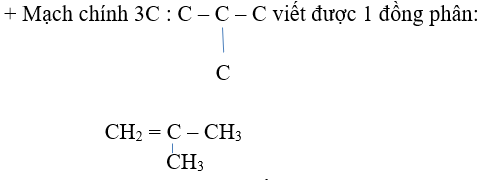
- Mạch vòng còn chỉ có link đơn
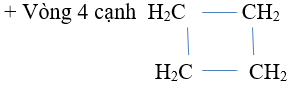
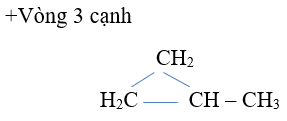
Vậy gồm 5 đồng phân.
Bài 2: Tổng số link π cùng vòng ứng với công thức C5H11O2Cl
N2 là
Hướng dẫn:
Độ bất bão hòa Δ = (5.2-11+2-1+1.2)/2 =1
Nên phân tử có 1 nối song hoặc 1 vòng
Bài 3: Số công thức tạo mạch hở rất có thể có ứng với bí quyết phân tử C4H8 là
Hướng dẫn:
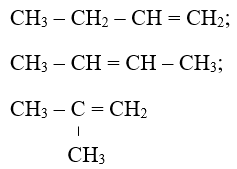
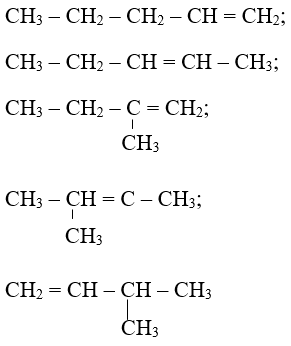
Bài 4: Số công thức tạo mạch có thể có ứng với công thức phân tử C5H10 là
Hướng dẫn:
Bài 5: Số công thức cấu trúc có thể tất cả ứng với những công thức phân tử C3H7Cl là
Hướng dẫn:
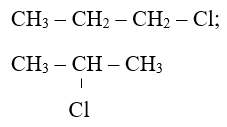
Bài 6: Số công thức cấu trúc có thể tất cả ứng với những công thức phân tử C4H10O là
Hướng dẫn:
CH3 – CH2 – CH2 – CH2 – OH ;
CH3 – CH2 – CH(OH) - CH3;
(CH3)2CH – CH2 – OH;
(CH3)3C – OH;
CH3 – CH2 – O – CH2 – CH3;
CH3 – O – CH2 – CH2 – CH3; CH3 – O – CH(CH3)2
B. Bài tập trắc nghiệm
Bài 1: Số công thức kết cấu mạch hở rất có thể có ứng với những công thức phân tử C4H10 là
A. 1 B. 2 C. 3 D. 4.
Lời giải:
Đáp án: B
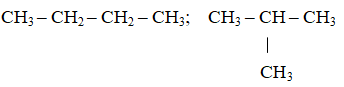
Bài 2: Số đồng phân mạch hở có thể có ứng với những công thức phân tử C4H9Cl là
A. 5 B. 2 C. 3 D. 4
Lời giải:
Đáp án: B
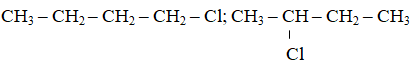
Bài 3: Số đồng phân mạch hở hoàn toàn có thể có ứng với những công thức phân tử C3H6Cl2 là
A. 5 B. 2 C. 3 D. 4
Lời giải:
Đáp án: D
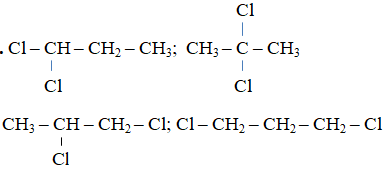
Bài 4: Số công thức cấu trúc mạch hở hoàn toàn có thể có ứng với các công thức phân tử C3H8O là
A. 1 B. 2 C. 3 D. 4.
Lời giải:
Đáp án: C
CH3 – CH2 – CH2 – OH; CH3 – CH(OH) – CH3; CH3 – O – CH2 – CH3
Bài 5: Số công thức cấu tạo có thể có ứng với các công thức phân tử C2H7N là
A. 3 B. 2 C. 1 D. 4.
Lời giải:
Đáp án: B
CH3 – CH2 – NH2; CH3 – NH – CH3
Bài 6: Số công thức cấu tạo mạch hở có thể có ứng với các công thức phân tử C2H4O là
A. 3 B. 2 C. 1 D. 4.
Lời giải:
Đáp án: C
CH3 – CH = O
Bài 7: vitamin A có công thức phân tử là C20H30O, bao gồm chứa 1 vòng 6 cạnh và không có chứa liên kết ba. Số link đôi vào phân tử vi-ta-min A là
A. 7 B. 6 C. 5 D. 4.
Lời giải:
Đáp án: C
Bài 8: Lycopen bao gồm công thức phân tử C40H56, là chất màu đỏ trong quả cà chua, có kết cấu mạch hở, chỉ chứa links đôi và links đơn trong phân tử. Số kết song đó gồm trong phân tử licopen là
Bài tập từ bỏ luận môn chất hóa học lớp 11 - Chương 4: Đại cưng cửng về hóa học hữu cơ
A. Công thức đề nghị nhớ hóa hữu cơB. Bài tập hóa cơ học 11
Bài tập trường đoản cú luận môn hóa học lớp 11 - Chương 4: Đại cương cứng về hóa học hữu cơ tổng hợp các công thức nên nhớ và những dạng bài bác tập cơ phiên bản về hóa hữu cơ lớp 11, như xác định công thức phân tử hợp hóa học hữu cơ, xác định cân nặng mỗi nhân tố trong hợp hóa học hữu cơ...
A. Công thức đề xuất nhớ hóa hữu cơ
I. Xác định thành phần yếu tắc (m, %)
1. Xác định khối lượng các nguyên tố gồm trong m
A gam phù hợp chất:
2. Xác định % khối lượng các nguyên tố gồm trong m
A gam phù hợp chất:
II. Xác định trọng lượng phân tử của hóa học hữu cơ (MA)
1. Trường hợp mang lại tỷ khối hơi:
2. Trường hợp mang lại thể tích phân tử gam:
* Chú ý: Theo Định công cụ Avôgadrô: nhị chất không giống nhau ở cùng đk nhiệt độ cùng áp suất, chiếm cùng thể tích bọn chúng phải gồm cùng số mol.
III. Xác minh công thức phân tử (Cx
Hy
Oz
Nt)
1. Phụ thuộc vào công thức ĐGN nhưng mà xác định
2. Nhờ vào thành phần nguyên tố cơ mà xác định
3. Dựa vào phương trình phản nghịch ứng đốt cháy
Nếu đề bài bác cho đầy đủ các tỉ lệ thành phần trên ta xác định được rõ ràng các quý giá của x, y, z, t→ xác minh công thức phân tử
Nếu đề bài xích cho thiếu hụt một trong những tỉ lệ bên trên ta chỉ khẳng định được tỉ lệ thành phần của x:y:z:t→ Chỉ xác định được bí quyết ĐGN.
B. Bài tập hóa hữu cơ 11
Dạng 1: xác minh % cân nặng mỗi nguyên tố trong hợp chất hữu cơ
Bài 1. Đốt cháy trọn vẹn 0,92 gam hợp chất hữu cơ chiếm được 1,76 gam CO2 và 1,08 gam H2O. Khẳng định % khối lượng mỗi thành phần trong hợp chất hữu cơ.
Đáp án khuyên bảo giải bỏ ra tiết
Bảo toàn yếu tố "C": n
C = n
CO2 = 1,76/44 = 0,04 mol
Bảo toàn thành phần "H": n
H = 2.n
H2O = 2.(1,08/18) = 0,12 mol
Bảo toàn cân nặng => m
O = m
X - m
C - m
H = 0,92 - 12.0,04 - 0,12 = 0,32 gam
Bài 2. Đốt cháy trọn vẹn 7,75 g vi-ta-min C (chứa C, H, O) thu được 11,62 g CO2 với 3,17 g H2O. Xác minh % khối lượng mỗi thành phần trong phân tử vitamin C.
Đáp án chỉ dẫn giải đưa ra tiết
n
CO2 =11,62/44 =0,264 mol → n
C = 0,264mol
n
H2O =3,17/18 = 0,176 mol → n
H = 0,352mol
%m
C = 0,264.12/7,75.100% = 40,88%
%m
H = 0,352/7,75.100% = 4,54%%
m
O= 100% − 4,54% − 40,88% = 54,58%
Bài 3. Oxi hoá hoàn toàn 0,6 g hợp chất hữu cơ A nhận được 0,672 lít khí CO2 (ở đktc) cùng 0,72 g H2O. Tính thành phần xác suất của những nguyên tố vào phân tử chất A.
Đáp án lí giải giải bỏ ra tiết
n
CO2 = 0,672/22,4 = 0,03 mol
n
H2O = 0,72/18 = 0,04 mol
n
C = n
CO2 = 0,03 mol
n
H = 2n
H2O = 0,08 mol
%m = 0,03.120,6.100% = 60%
%m
H = 0,08.10,6.100% = 13,33%
%m
O = 100 − 60 −13,33 = 26,67%
Bài 4. Oxi hoá trọn vẹn 0,135 g hợp chất hữu cơ A rồi cho sản phẩm lần lượt qua bình 1 đựng H2SO4 đặc với bình 2 chứa KOH, thì thấy trọng lượng bình 1 tăng lên 0,117 g, bình 2 tăng lên 0,396 g. Ở phân tích khác, khi nung 1,35 g hợp chất A với Cu
O thì chiếm được 112 ml (đktc) khí nitơ. Tính thành phần tỷ lệ của những nguyên tố vào phân tử hóa học A.
Đáp án lý giải giải đưa ra tiết
Do khi oxi hóa cùng khi đốt có CO2, H2O và N2
=> Hợp hóa học hữu cơ A nên có các nguyên tố C, H, N và hoàn toàn có thể có O
=> mbình1tăng = m
H2O = 0,117(g)
=> n
H2O = 0,117/18 = 0,0065 (mol)
=>n
H = 2n
H2O = 2.0,0065 = 0,013 (mol)
=>mbình2tăng = m
CO2 = 0,39 6 (g)
=> n
CO2 = 0,396/44 = 0,009 (mol) => n
C = n
CO2 = 0,009 (mol)
n
N2 = 11,2/1000.22,4 = 0,0005(mol) =>n
N = 2n
N2 = 0,0005.2 = 0,001 (mol)
=>m
A = m
C + m
H + m
N = 0,009.12 + 0,013.1+ 0,001.14 = 0,135 (g)
=> A không tồn tại Oxi
=> Đặt bí quyết hóa học: Cx
Hy
Nz
=> x:y:z = 0,009:0,013:0,001 = 9:13:1
=> CTHH : C9H13N
Bài 5. Oxi hoá hoàn toàn 0,46 g hợp hóa học hữu cơ A, dẫn thành phầm lần lượt qua bình 1 cất H2SO4 đặc cùng bình 2 đựng KOH dư thấy cân nặng bình 1 tăng 0,54 g bình 2 tăng 0,88 g. Tính thành phần phần trăm của các nguyên tố vào phân tử chất A.
Đáp án gợi ý giải chi tiết
A + O2

Bình 1 tăng là vì H2O bị duy trì lại.
→ m
H2O = 0,54 gam
→ n
H2O= 0,54/18 = 0,03 mol
Bình 2 là do CO2 phản bội ứng bị giữ lại
→ m CO2 = 0,88 gam
→ n
CO2 = 0,88/44 = 0,02 mol
→ n
C = n
CO2 = 0,02 mol
n
H = 2n
H2O= 0,06 mol
→ m
C= 0,02.12 = 0,24 gam
m
H =0,06.1= 0,06 gam
→%m
C= 0,24/0,46 .100 = 52,174%
%m
H=0,06/0,46 .100 =13,04%
→%m
O =100%− 52,174% − 13,04% = 34,786%
Bài 6. A là 1 trong chất hữu cơ chỉ chứa 2 nguyên tố. Lúc oxi hoá trọn vẹn 2,50 g hóa học A người ta thấy sinh sản thành 3,60 g H2O. Khẳng định thành phần định tính cùng định lượng của chất A.
Bài 7. lúc oxi hoá trọn vẹn 5,00 g một hóa học hữu cơ, tín đồ ta nhận được 8,40 lít khí CO2 (đktc) và 4,5 g H2O. Khẳng định phần trăm khối lượng của từng thành phần trong hợp hóa học hữu cơ đó.
Bài 8. Để đốt cháy trọn vẹn 2,50 g chất A cần dùng vừa hết 3,36 lít O2 (đktc). Thành phầm cháy chỉ gồm CO2 cùng H2O, vào đó cân nặng CO2 hơn cân nặng H2O là 3,70 g. Tính phần trăm trọng lượng của từng nguyên tố trong A.
Bài 9. Oxi hoá hoàn toàn 6,15 g hóa học hữu cơ X, tín đồ ta thu được 2,25 g H2O; 6,72 lít CO2 với 0,56 lít N2 (các thể tích đo ở đktc).
Dạng 2: Lập CTPT hợp chất hữu cơ
Phần bài tập chỉ dẫn giải
Bài 1. Nilon – 6, loại tơ nilon phổ biến nhất bao gồm 63,68% C; 9,08 % H; 14,14% O; và 12,38% N. Xác minh công thức đơn giản nhất của nilon – 6.
Hướng dẫn giải bài xích tập
Ta có n
C:n
H:n
N =

Công thức thực nghiệm của nilon là C6H11ON
Bài 2. Công dụng phân tích các nguyên tố vào nicotin như sau: 74% C; 8,65% H; 17,35% N. Xác minh công thức dễ dàng và đơn giản nhất của nicotin, biết nicotin có trọng lượng mol phân tử là 162.
Đáp án lý giải giải
Gọi CT nicotin là Cx
Hy
Nz
x : y : z = %C/12: %H/1: %N/14 = 74/12 : 8,65/1 : 17,35/14= 5: 7 :1
=> CT (C5H7N)n . Cơ mà M = (12.5 + 7 + 14)n = 162 => n = 2 => CT: C10H14N2
Bài 3. Đốt cháy hoàn toàn 5,6 g hợp chất hữu cơ A nhận được 13,2 g CO2 cùng 3,6 g H2O. Tỉ khối của A so với H2 là 28. Xác định CTPT của A.
Đáp án lý giải giải
Ta bao gồm n
CO2 = n
C = 0,3
n
H = 2n
H2O = 0,4
m
O trong A = 5,6 - 0,3.12 - 0,4= 1,6 => n
O = 0,1mol
=> CT (C3H4O)n . M = ( 12.3 + 4 + 16)n = 28.2=> n = 1 => CT A: C3H4O
Bài 4. Đốt cháy trọn vẹn 0,30 g chất A (chứa C, H, O) nhận được 0,44 g CO2 cùng 0,18 g H2O. Thể tích hơi của của 0,30 g chất A bởi thể tích của 0,16g khí oxi (ở cùng đk về ánh nắng mặt trời và áp suất). Xác định CTPT của hóa học A.
Đáp án khuyên bảo giải
Gọi cách làm hợp chất hữu cơ là Cx
Hy
Oz (x,y,z nguyên dương)
m
O = m
A – (m
C + m
H) = 0,3 - (0,01.12 + 0,02.1) = 0,16(g)
⇒ n
O = = 0,01(mol)
n
C : n
H : n
O = 0,01 : 0,02 : 0,01 = 1 : 2 : 1
⇒ cách làm phân tử (CH2O)n
Ta có: m
A = 30n = 60 ⇒ n = 2
⇒ cách làm phân tử của A là C2H4O2
Bài 5. Từ tinh dầu hồi, người ta bóc tách được anetol – một chất thơm được sử dụng sản xuất kẹo cao su. Anetol có khối lượng mol phân tử bởi 148 g/mol. Phân tích nguyên tố cho thấy, anetol bao gồm %C = 81,08%; %H = 8,10% còn sót lại là oxi. Lập công thức dễ dàng nhất và CTPT của anetol.
Đáp án lý giải giải
%O = 100% - 81,08% - 8,1% = 10, 82%
x : y : z =

= 10: 12: 1
=> Công thức đơn giản nhất = C10H12O
=> (C10H12O)n = 148 => n = 1 => CTPT : C10H12O
Bài 6. Hợp hóa học X gồm phần trăm cân nặng C, H, O lần lượt bằng 54,54%; 9,10% cùng 36,36%. Trọng lượng mol phân tử của X bằng 88. Xác định CTPT của X.
Đáp án lý giải giải
Gọi công thức tổng thể của X là Cx
Hy
Oz (x,y,z € N*)

=> Công thức đơn giản dễ dàng nhất của X là C2H4O
=> Công thức tổng thể là (C2H4O)n
Ta có: MX = 88 (g/mol)
(12.2 + 4+ 16)n = 88
=> n = 2
Vậy cách làm phân tử là C4H8O2
Bài 7. Từ tinh dầu chanh bạn ta tách bóc được chất limonen thuộc một số loại hiđrocacbon tất cả hàm lượng yếu tố H là 11,765%. Hãy tìm CTPT của limonen, biết tỉ khối khá của limonen so với heli bởi 34.
Đáp án chỉ dẫn giải
Gọi cách làm của limonen là Cx
Hy
Ta có:
%H = 100% - %H = 100% -11,765% = 88,235%
Dlimonen/kk = 4,69 →Mlimonen = 4,69.29 = 136
Ta có:

→ x : y = 5: 8
Vậy công thức dễ dàng và đơn giản nhất của limonen là (C5H8)n
Vì Mlimonen = 136 →→ n(12.5 + 8.1) = 136 →→ n = 2
Vậy bí quyết phân tử của limonen là C10H16
Bài 8. Đốt cháy trọn vẹn hợp hóa học hữu cơ A nên vừa đủ 6,72 lít O2 (ở đktc) thu được 13,2 g CO2 với 5,4 g H2O. Biết tỉ khối khá của A so với không gian gần bởi 1,0345. Xác định CTPT của A.
Đáp án trả lời giải
n
O2 = 6,72 : 22,4 = 0,3 mol
Bảo toàn khối lượng: m
A + m
O2 = m
H2O + m
CO2
→ m
A = 13,2 + 5,4 - 0,3 . 32 = 9 (g)
n
CO2 = 13,2 : 44 = 0,3 mol
n
H2O = 5,4 : 18 = 0,3 mol
Gọi CTPT của A là Cx
Hy
Oz
Trong A có:
n
C = n
CO2 = 0,3 mol
n
H = 2n
H2O = 0,6 mol
Bảo toàn yếu tắc O: n
O = 2.n
CO2 + n
H2O - 2.n
O2 = 0,3 mol
x:y:z = n
C : n
H : n
O = 0,3 : 0,6 : 0,3 = 1:2:1
→ CTĐGN của A: CH2O
→ A gồm dạng (CH2O)n
MA = 29 . 1,0345 = 30
30n = 30 → n = 1
Phần bài tập từ luyện
Bài 9. Đốt cháy trọn vẹn 2,20 g hóa học hữu cơ X bạn ta chiếm được 4,40 g CO2 với 1,80 g H2O.
Xác định công thức dễ dàng nhất của chất X.Xác định CTPT chất X hiểu được nếu làm bay hơi 1,10 g hóa học X thì thể tích hơi thu được đúng bởi thể tích của 0,40 g khí oxi ở cùng đk ánh nắng mặt trời và áp suất.Đáp án lý giải giải
a/ Ta có: n
CO2 = 0,1 mol ⇒ m
C =1,2 (g)
n
H2O = 0,1 mol ⇒ m
H = 0,2 (g)
Ta có: m
A > m
C + m
H
Vậy vào A gồm O ⇒m
O = m
A −(m
C + m
H) = 0,8 (g) →n
O = 0,05 (mol)
Gọi cách làm của chất hữu cơ A: Cx
Hy
Oz
Khi đó: x : y : z = n
C:n
H:n
O = 0,1 : 0,2 : 0,05 = 2 : 4 : 1
⇒ công thức dễ dàng nhất của A: C2H4O
b/ Ta có: n
A = n
O2 = 0,4/32 = 0,0125 mol
⇒ MA = 1,1/0,0125 = 88
⇒(12 + 4 + 32).n = 88 →n = 2
Vậy A là: C4H8O2
Bài 10. Để đốt cháy hoàn toàn 2,85 g chất hữu cơ X buộc phải dùng không còn 4,20 lít khí oxi (đktc). Sản phẩm cháy chỉ bao gồm CO2 cùng H2O theo tỉ lệ trọng lượng 44 : 15.
Xác định công thức dễ dàng nhất của X.Xác định CTPT của X hiểu được thỉ khối tương đối của X so với C2H6 là 3,80.Đáp án giải đáp giải
Sơ thiết bị phản ứng: X + O2 → CO2 + H2O
n
O2 = 0,1875 mol
Gọi cân nặng của CO2 cùng H2O tương ứng là 44a và 15a.
Bảo toàn khối lượng:
m
X + m
O2 = m
CO2 + m
H2O

Bảo toàn nhân tố C, H:
n
C(X) = n
CO2 = 0,15mol; n
H(X) = 2n
H2O = 0,25mol
Ta có
m
X = m
C + m
H + m
O
→ m
O = 2,85−0,15.12−0,25.1 = 0,8 gam
→ n
O = 0,05 mol
Xét tỉ lệ: n
C : n
H : n
O = 0,15:0,25:0,05 = 3:5:1
→ Công thức đơn giản nhất của chất X là: C3H5O
b. Bí quyết phân tử của X có dạng: (C3H5O)n
Ta có:
d
X/C2H6 = 3,8→MX = 3,8.30 = 114 →(12.3+5+16).n = 114 → n = 2
Công thức phân tử của hóa học X: C6H10O2
*Bài 11. Để đốt cháy trọn vẹn 4,45 g chất hữu cơ X nên dùng hết 4,20 lít khí oxi (đktc). Sản phẩm cháy gồm tất cả 3,15 g H2O và 3,92 lít các thành phần hỗn hợp khí bao gồm CO2 với N2 (đktc). Xác minh CTĐGN của X.
n
O2 = 0,1875 mol ; n
H2O = 0,175 mol
Đặt n
CO2 = x; n
N2 = y
+ Bảo toàn trọng lượng : 44x + 28y = m
A + m
O2 – m
H2O = 7,3g (1)
+ n(CO2 + N2) = 0,175 => x + y = 0,175 (2)
=> x = 0,15 ; y = 0,025 mol
Bảo toàn O : n
O(A) = 2n
CO2 + n
H2O – 2n
O2 = 0,1 mol
=> n
C : n
H : n
O : n
N = 0,15 : 0,35 : 0,1 : 0,05 = 3 : 7 : 2 : 1
Công thức phân tử của A chỉ có 1 nguyên tử N => A là C3H7O2N
bài tập vận dụng tự luyện
Bài 12. HCHC A gồm thành phần phần trăm khối lượng các nhân tố như sau: C chỉ chiếm 24,24%; H chiếm phần 4,04%; Cl chiếm phần 71,72%.
Xác định công thức đơn giản dễ dàng nhất của A.Xác định CTPT của A hiểu được tỉ khối hơi của A đối với CO2 là 2,25.Bài 13. kiếm tìm CTPT chất hữu cơ trong mỗi trường đúng theo sau:
Đốt cháy trọn vẹn 10 g hợp chất, chiếm được 33,85 g CO2 và 6,94 g H2O. Tỉ khối tương đối của hợp chất so cùng với KK là 2,69.Đốt cháy 0,282 g hợp hóa học và mang lại các sản phẩm sinh ra đi qua những bình đựng CaCl2 khan và KOH thấy bình đựng Ca
Cl2 khan tạo thêm 0,194 g, bình KOH tăng lên 0,80 g. Còn mặt khác đốt cháy 0,186 g hóa học đó, nhận được 22,4 ml nitơ (ở đktc). Phân tử chỉ chứa một nguyên tử nitơ.
Bài 14. Đốt cháy hoàn toàn một lượng chất hữu cơ gồm chứa C, H, Cl hiện ra 0,22 g CO2 và 0,09 g H2O. Khi xác định clo trong lượng hóa học đó bởi dd Ag
NO3 bạn ta chiếm được 1,435 g Ag
Cl.
Bài 15. đối chiếu một HCHC mang lại thấy: cứ 2,1 phần cân nặng C lại sở hữu 2,8 phần khối lượng O với 0,35 phần trọng lượng H. Hãy khẳng định CTPT của chất hữu cơ bên trên biết 1,00 g hơi hóa học đó ở đktc chiếm phần thể tích 373,3 cm3.
Bài 16. Đốt cháy trọn vẹn 0,9 g HCHC A nhận được 1,32 g CO2 với 0,54 g H2O. Tỉ khối của A đối với H2 là 45. Xác định CTPT của A.
Bài 17. Đốt cháy hoàn toàn 100 ml hơi chất A nên 250 ml oxi tạo nên 200 ml CO2 cùng 200 ml tương đối H2O. Khẳng định CTPT của A, biết thể tích những khí đo ở cùng đk về ánh nắng mặt trời và áp suất.
Bài 18. khi đốt 1 lít khí A đề nghị 5 lít oxi sau pư chiếm được 3 lít CO2 và 4 lít tương đối H2O. Xác định CTPT của A, biết thể tích các khí đo ở cùng đk về nhiệt độ và áp suất.
Bài 19. Từ ơgenol (trong tinh dầu mùi hương nhu) pha chế được metylơgenol (M = 178 g/mol) là hóa học dẫn dụ côn trùng. Kết quả phân tích thành phần của metylơgenol cho thấy: %C = 74,16%; %H = 7,86%, sót lại là oxi. Lập công thức dễ dàng và đơn giản nhất, CTPT của metylơgenol.
Bài 20: xác định CTPT của từng chất trong số trường thích hợp sau:
a. Tính phần nguyên tố: 85,8%C; 14,2%H; d
A/H2 = 28.
b. 51,3%C; 9,4%H; 12%N; 27,3%O; d
A/KK = 4,035
ĐS: C4H8; C5H11O2N
Bài 21: kiếm tìm CTPT của mỗi chất trong từng trường hợp sau:
a. Đốt cháy 0,6g hóa học hữu cơ A thì nhận được 0,88g CO2 và 0,36g H2O với d
A/H2 = 30.
b. Đốt cháy 7g chất hữu cơ B thì nhận được 11,2 lít CO2 (đkc) cùng 9g H2O. Cân nặng riêng của B ở đkc là 1,25g/l
c. Đốt cháy hoàn toàn 10g chất hữu cơ C chiếm được 33,85g CO2 cùng 6,94g H2O. Tỷ khối tương đối của C so với không gian là 2,69.
ĐS: C2H4O2; C2H4; C6H6
Bài 22: Đốt cháy hoàn toàn m(g) một Hydrocacbon A thì nhận được 2,24 lít CO2 (đkc) cùng 3,6g H2O.
a. Tính m cùng % khối lượng các nhân tố trong A?
b. Xác định CTN; CTPT của A biết d
A/H2 = 8.
ĐS: 1,6g; 75%; 25%; CH4
Bài 23: tìm kiếm CTN cùng CTPT của mỗi chất trong từng trường đúng theo sau:
a. Đốt cháy 0,176g hợp chất A xuất hiện 0,352g CO2 với 0,144g H2O. Biết d
A/KK = 1,52.
b. Phân tích 0,31g hóa học hữu cơ B (C; H; N) thì thu được 0,12g C với 0,05g H. Biết d
B/H2 = 15,5.
c. Phân tích hóa học hữu cơ D thì thấy cứ 3 phần trọng lượng C thì tất cả 0,5 phần trọng lượng H cùng 4 phần trọng lượng O. Biết d
D/H2 = 30.
ĐS: C2H4O; CH5N; C2H4O2
Bài 24: Đốt cháy trọn vẹn 0,9g một chất hữu cơ bao gồm thành phần gồm các nguyên tố C, H, O người ta thu được 1,32g CO2 với 0,54g H2O. Cân nặng phân tử hóa học đó là 180đv
C. Hãy xác định CTPT của chất hữu cơ nói trên ?
ĐS: C6H12O6
Bài 25: Đốt cháy trọn vẹn 5,2g hợp hóa học hữu cơ A rồi cho sản phẩm lần lượt qua bình H2SO4 đđ thì khối lượng bình tăng 1,8g cùng qua lọ nước vôi vào dư thì gồm 15g kết tủa. Xác minh CTPT của A biết d
A/O2 = 3,25.
ĐS: C3H4O4
Bài 26: Đốt cháy hoàn toàn một lượng Hydrocacbon A rồi cho toàn bộ sản phẩm theo thứ tự qua bình một đựng H2SO4 đđ rồi qua bình nhì đựng nước vôi trong dư. Sau thí nghiệm khối lượng bình một tăng 0,36g với bình hai gồm 2g kết tủa trắng.
a. Tính % khối lượng các nguyên tố trong A ?
b. Khẳng định CTN với CTPT của A biết d
A/KK = 0,965 ?
c. Nếu ta đổi khác thứ tự hai bình bên trên thì độ tăng trọng lượng mỗi bình ra sao sau nghiên cứu ?
ĐS: 85,71%; 14,29%; C2H4; tăng 1,24g cùng không đổi
Bài 27: Đốt cháy trọn vẹn 10,4g hợp chất hữu cơ (A) rồi cho cục bộ sản phẩm theo thứ tự qua bình một đựng H2SO4 đđ rồi qua bình nhị đựng nước vôi trong dư. Sau thí nghiệm cân nặng bình một tăng 3,6g với bình hai bao gồm 30g kết tủa trắng. Lúc hóa khá 5,2g (A) thu được tiện tích đúng bởi thể tích của 1,6g khí O2 sinh hoạt cùng điều kiện nhiệt độ với áp suất. Xác định CTPT của (A)?
ĐS: C3H4O4
Bài 28: Đốt cháy 0,45g hóa học hữu cơ A rồi cho toàn cục sản phẩm qua chai nước vôi vào dư thì có 112 cm3 N2 (đkc) thoát ra khỏi bình, khối lượng bình tăng 1,51g và có 2g kết tủa trắng.
a. Xác minh CTN với CTPT của A hiểu được 0,225g A lúc ở thể khí chiếm phần một thể tích đúng bằng thể tích chiếm vị 0,16g O2 đo sinh hoạt cùng đk ?
b. Tính khối lượng Oxy nên cho làm phản ứng cháy nói trên ?
ĐS: C2H7N; 1,2g
Bài 29: Đốt cháy hoàn toàn 3,2g một chất hữu cơ A rồi dẫn thành phầm qua bình cất nước vôi vào dư thấy khối lượng bình tăng 13,44g và có 24g kết tủa. Biết d
A/KK = 1,38. Khẳng định CTPT của A?
ĐS: C3H4
Bài 30: Đốt cháy hoàn toàn 0,6g hóa học hữu cơ A rồi cho thành phầm qua chai lọ đựng nước vôi trong dư thấy tất cả 2g kết tủa và khối lượng bình tăng thêm 1,24g.
Xem thêm: Những câu nói hay về tình mẹ dành cho con ấm áp, ngọt ngào, những câu nói hay về mẹ và tình mẹ dành cho con
a. Kiếm tìm CTN của A?
b. Tra cứu CTPT của A biết 3g A có thể tích bởi thể tích của 1,6g O2 trong thuộc điều kiện?
ĐS: C2H4O2
-----------------------------------------------
Trên trên đây Vn
Doc.com vừa ra mắt tới những bạn nội dung bài viết Bài tập từ bỏ luận môn hóa học lớp 11 - Chương 4: Đại cương về hóa học hữu cơ, mong rằng qua nội dung bài viết này các bạn cũng có thể học tập xuất sắc hơn môn hóa học lớp 11. Mời các bạn cùng bài viết liên quan kiến thức những môn Toán 11, Ngữ văn 11, giờ đồng hồ Anh 11, đề thi học tập kì 1 lớp 11, đề thi học tập kì 2 lớp 11...